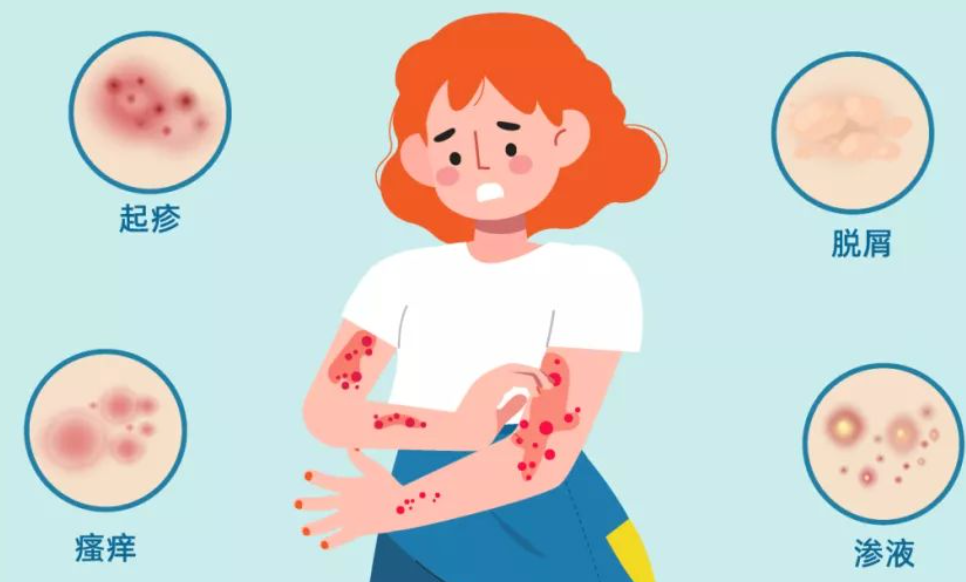
AD的确切发病机制尚不清楚,但目前研究认为,免疫异常、皮肤屏障功能障碍、皮肤菌群紊乱等因素是本病发病的重要环节[1]。因此,AD的治疗的主要策略为缓解瘙痒、降低皮肤炎性反应,免疫抑制,消除AD诱发或恶化的因素。
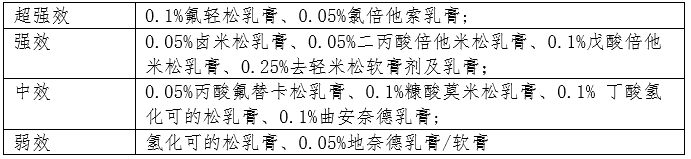
颈部及皱褶部位推荐短期使用中弱效TCS。肥厚性皮损可选用封包疗法。急性期泛发性严重或者顽固皮损推荐短期(通常3d,时间不超过14d)湿包治疗,可快速有效控制症状,该疗法特别适用于不宜系统用药的儿童患者。
中重度或易复发AD患者皮损控制后,应过渡到长期”主动维持治疗”,即在易复发的原有皮损区每周2次外用TCS或TCI,配合全身外用保湿润肤剂,能有效减少复发,减少外用糖皮质激素用量。
长期大面积使用TCS可能导致皮肤和系统不良反应。但不用过分担心,甚至拒绝用药,以免延误病情。遵医嘱正确合理使用药物,可以安全快速地控制疾病并减少不良反应的发生。
外用钙调神经磷酸酶抑制剂(TCI)是治疗AD重要的抗炎药物。推荐用于面颈部、褶皱部位以及乳房、肛门外生殖器部位控制炎症与瘙痒症状或用于主动维持治疗减少复发。
1%吡美莫司乳膏多用于轻中度AD。0.03%(儿童用)与0.1%(成人用)他克莫司软膏用于中重度AD。
不良反应主要为局部烧灼和刺激感,大部分患者可随用药时间延长而逐步消失;部分患者(特别是急性期时)不能耐受药物刺激反应,建议先用TCS控制急性症状后,转换为TCI维持治疗。
对于瘙痒明显或伴有睡眠障碍患者可尝试选用第一代或第二代抗组胺药。
考虑到第一代抗组胺药如苯海拉明、扑尔敏和异丙嗪等对睡眠质量及学习认知能力的影响,不推荐长期使用。
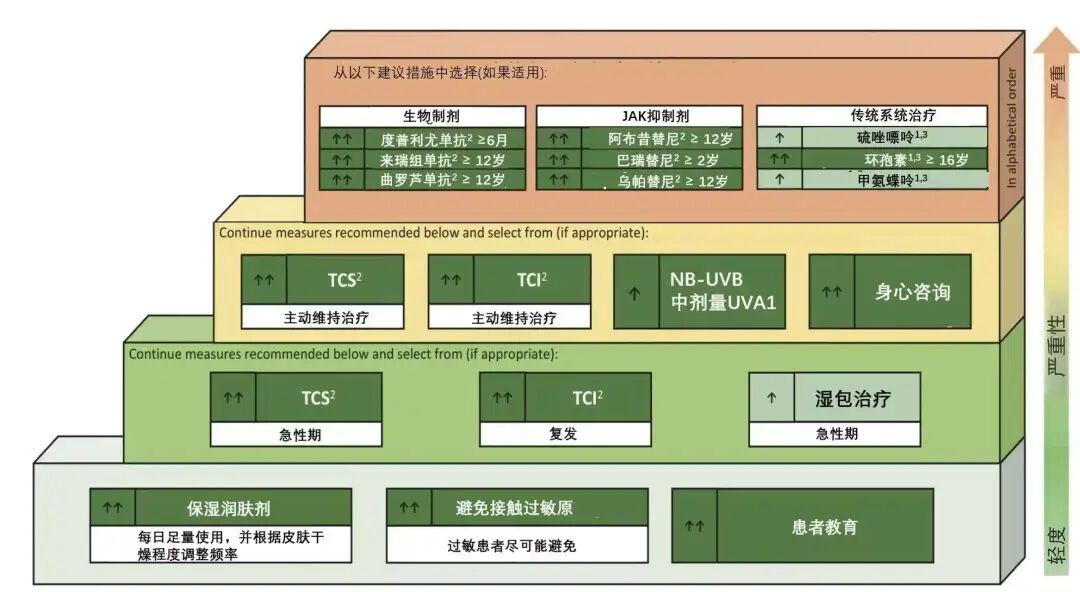
免疫抑制剂适用于重度AD且常规疗法不易控制的患者,使用时间多需6个月以上。
常用免疫抑制剂为环孢素、甲氨蝶吟、硫唑嘌呤。
应用免疫抑制剂时必须注意适应证和禁忌证,并且应密切监测不良反应。
原则上不推荐系统使用糖皮质激素。仅对病情严重、其他药物难以控制的急性发作期患者可短期应用,推荐剂量0.5 mg/kg/d(以甲泼尼松龙计),病情好转后及时减量停药。
对于较顽固病例,可先用糖皮质激素治疗,之后逐渐过渡到免疫抑制剂或紫外线疗法。避免长期应用,以防止或减少不良反应的发生。
生物制剂异军突起,可作为中重度AD患者系统治疗的一线选择。中重度AD患者一直饱受剧烈瘙痒和大面积皮损的折磨,缺乏安全有效的治疗方案。生物制剂的引入带来最前沿的创新治疗方案。目前获批治疗外用药控制不佳或不建议使用外用药的6岁及以上儿童和成人中重度特应性皮炎。作为一项针对性疗法,可靶向IL-4和IL-13,阻断介导AD发生发展的通路和下游的生物学作用。度普利尤单抗已经多项大型临床试验证实,其对于成人中重度AD具有良好疗效[2-4],配合外用药物及保湿剂可用于长期维持治疗。
《2017美国多学科专家共识》[5]、《2019澳大利亚共识:成人AD的管理》[6]等国外共识推荐度普利尤单抗作为局部治疗无效的中重度AD成年患者的一线系统治疗选择。
- 减少各类刺激,避免接触过敏原。
- 合理洗浴去除皮肤表面污秽痂皮降低皮肤表面金黄色葡萄球菌定植数量。
- 坚持外用保湿润肤剂,尤其是在洗浴后立即使用,以便恢复和维持皮肤屏障功能。
- 中华医学会皮肤性病学分会免疫学组, 特应性皮炎协作研究中心. 中华皮肤科杂志, 2020, 053(002):81-88.
- J Am Acad Dermatol. 2020 Feb; 82(2):377-388.
- JAMA Dermatol. 2020 Jan 1;156(1):44-56.
- JAMA Dermatol. 2020 Feb 1;156(2):131-143.
- Boguniewicz M, et al. J Allergy Clin Immunol Pract. 2017;5(6):1519-1531.
- Smith S, et al. Australas J Dermatol. 2019 Aug 1. doi: 10.1111/ajd.13124.
本编号仅作为对本文章所涉及的相关药物所属治疗领域科学和临床数据来源真实性的确认,不作为对本文章全部内容准确性、时效性和完整性的确认和保证;本文章仅供医疗卫⽣专业⼈⼠为学术交流或了解医学资讯⽬的使⽤,不构成对任何药物或治疗⽅案的推荐和推⼴。本文章所含信息不应代替医疗卫⽣专业⼈⼠提供的医疗建议。



请勿重复进群


加入#中国AD之家#患者微信群


群号:1102465325




Leave a Reply