特应性皮炎(Atopic Dermatitis, AD)是一种慢性、复发性、炎症性皮肤病,核心病理机制涉及皮肤屏障功能受损、免疫失衡(如 Th2 型炎症反应过度激活)及皮肤微环境紊乱,传统治疗(如外用糖皮质激素、免疫抑制剂、生物制剂)虽能缓解症状,但部分患者存在疗效不佳、复发率高或副作用等问题。
干细胞凭借其免疫调节、组织修复及抗炎特性,为特应性皮炎的治疗提供了新方向,目前相关研究主要集中在基础实验和早期临床探索阶段。
用于特应性皮炎研究的主要干细胞类型
不同来源的干细胞在 AD 治疗中展现出相似的核心功能,但在获取难度、免疫原性等方面存在差异,临床应用潜力各有侧重:
|
|
|
|
|
|---|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
干细胞治疗特应性皮炎的核心作用机制
干细胞并非直接 “杀灭” 炎症细胞,而是通过多途径调控皮肤微环境、修复屏障并平衡免疫,从病理根源改善 AD:
-
修复受损的皮肤屏障 AD 的关键诱因是皮肤屏障(如角质层、紧密连接)破坏,导致水分流失和外界过敏原入侵。
-
干细胞(尤其是 MSC、ESC)可通过分化为表皮细胞、角质形成细胞,直接补充受损的皮肤细胞,促进角质层再生; -
分泌表皮生长因子(EGF)、成纤维细胞生长因子(FGF) 等细胞因子,激活皮肤局部修复通路,增强角质形成细胞的增殖与迁移能力,重建皮肤紧密连接(如 Claudin-1、Occludin 蛋白表达增加),减少经皮水分流失(TEWL)。
-
调节失衡的免疫系统 AD 的核心免疫异常是Th2 型炎症占主导(IL-4、IL-5、IL-13 等细胞因子过度分泌),同时伴随 Th17 炎症激活、调节性 T 细胞(Treg)功能不足。
-
干细胞通过 “旁分泌效应”(分泌可溶性因子)和 “细胞间直接作用” 调控免疫: -
抑制 Th2/Th17 细胞活化:分泌转化生长因子 -β(TGF-β)、白细胞介素 – 10(IL-10) ,下调 Th2 细胞分泌的 IL-4、IL-13,减少嗜酸性粒细胞、肥大细胞的活化与浸润; -
促进 Treg 细胞生成:通过 TGF-β 诱导 naive T 细胞分化为 Treg 细胞,增强免疫抑制作用,抑制过度炎症反应; -
抑制树突状细胞(DC)成熟:减少 DC 细胞表面共刺激分子(如 CD80、CD86)的表达,降低其激活 T 细胞的能力,从源头抑制炎症启动。
-
抑制皮肤过度瘙痒与纤维化
-
瘙痒是 AD 患者的主要困扰,干细胞分泌的 IL-10、TGF-β 可下调皮肤中神经生长因子(NGF) 的表达,减少神经末梢对瘙痒信号的感知与传导 -
长期慢性炎症可能导致皮肤纤维化,MSC 可通过抑制成纤维细胞过度增殖及胶原沉积,避免皮肤增厚、硬化等后遗症。
临床研究进展与应用现状
目前干细胞治疗 AD 仍以早期临床探索(Ⅰ/Ⅱ 期试验) 为主,尚无成熟方案获批用于临床,现有研究结果显示出一定安全性和初步疗效。
干细胞条件培养基方向的案例:
国内一联合研究团队在国际期刊《Stem Cell Research & Therapy》发表了一项重要研究,题为《Human umbilical cord mesenchymal stem cell therapy for atopic dermatitis through inhibition of neutrophil chemotaxis》此项研究聚焦特应性皮炎(AD),探索了人脐带间充质干细胞(hUC-MSCs)及其衍生的条件培养基(hUC-MSC-CM)的临床潜力和作用机制,为 AD 的临床治疗提供了全新思路。

为了验证 hUC-MSCs 和 hUC-MSC-CM 的疗效,研究团队构建了两种常见的 AD 小鼠模型,研究团队对模型小鼠进行干预:部分小鼠皮下注射 hUC-MSCs,部分注射 hUC-MSC-CM(干细胞分泌的液体成分),并通过组织病理学检查、Western blotting、PCR、ELISA、流式细胞术等多种方法,评估皮肤损伤程度、炎症水平、免疫指标等变化。实验结果:无论是 hUC-MSCs 还是 hUC-MSC-CM,都能显著缓解 AD 样症状。
在两种小鼠模型中,治疗后小鼠的皮肤红斑、表皮增厚、炎症细胞聚集等问题明显减轻,皮肤屏障功能相关的标志物(如角蛋白 1、丝聚蛋白)表达增加,提示皮肤屏障得到修复。同时,小鼠血清中的免疫球蛋白 E(IgE,AD 的关键炎症指标)水平显著下降,炎症因子(如白细胞介素 – 4、白细胞介素 – 6)的分泌也受到抑制。更重要的是,接受治疗的小鼠未出现体重下降,证明这种治疗方式安全性较高。尤其值得关注的是,hUC-MSC-CM(无细胞的液体成分)与 hUC-MSCs 的疗效相当。这一发现意义重大:相比完整的干细胞治疗,无细胞的条件培养基能进一步降低致癌风险,更便于储存和应用,为临床转化提供了更便捷的选择。
干细胞外泌体的案例
一项发表于《Journal of Dermatological Tre-atment》上的研究显示干细胞外泌体仅需2周即可显著改善患者的红斑,95%患者表示满意。

研究团队纳入了 20 例诊断为面部红斑(DFR) 的成人特应性皮炎患者并对其进行12周临床试验,参加该项研究的受试者需要每周都进行干细胞外泌体制剂的局部涂抹,连续五周。研究效果用受试者者的研究者平均总体评估分数(IGA)、临床红斑评估量表(CEA)以及受试者满意度进行评估。
受试者的平均 IGA 评分从第 2 周开始下降,并持续下降至第 12 周。受试者的平均 CEA 评分也展现出相同的趋势,从第一次外泌体应用后的第一周开始下降。
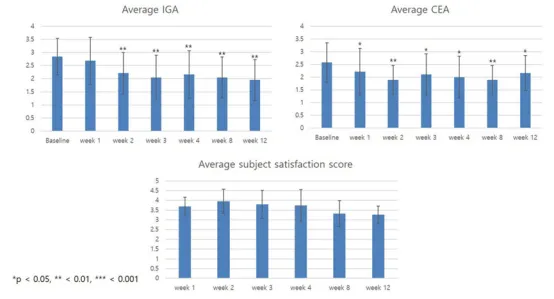
对于满意度而言,95%受试者也对效果表示满意(评分≥4分),且无严重副作用。受试者的直观效果:双脸颊、前额和下巴的红斑较前均有所改善。
研究者表示:尽管目前样本量较小且缺乏对照组,但外泌体的多重修复机制为DFR治疗提供了全新思路,是一种DFR患者的全新选择。
当前挑战与未来方向
尽管干细胞治疗 AD 展现出潜力,但仍面临诸多问题需解决:
-
核心挑战
-
标准化问题:干细胞来源(脐带 / 脂肪 / 骨髓)、体外扩增条件、细胞剂量、给药途径尚未统一,不同研究结果难以对比; -
长期安全性:需更长时间(5-10 年)随访验证干细胞是否存在潜在致瘤风险(尤其是 iPSC)、免疫排斥(异体 MSC 虽低但仍可能发生); -
机制未完全明确:干细胞对 AD 的免疫调节、屏障修复的具体分子通路仍需深入研究,以优化治疗方案; -
成本与可及性:iPSC 等技术成本高,异体 MSC 的质控体系复杂,短期内难以普及。
-
未来发展方向
聚焦 “干细胞外泌体”:外泌体含干细胞的核心活性成分,无细胞存活、增殖相关风险,且易储存、运输,可能成为更安全的 “无细胞治疗” 方案;
-
个性化治疗:根据患者 AD 严重程度、免疫分型(如 Th2 主导 / Th17 主导),选择合适的干细胞类型、剂量及给药方式; -
联合治疗:探索干细胞与传统治疗(如低剂量生物制剂、皮肤屏障修复剂)的协同作用,进一步提升疗效、减少复发。
总结
干细胞(尤其是间充质干细胞)通过修复皮肤屏障、调节免疫失衡、抑制炎症与瘙痒,为特应性皮炎的治疗提供了新的 “病因治疗” 思路。目前研究处于早期阶段,虽显示出初步安全性和疗效,但仍需大规模、长期的临床研究验证其有效性与安全性,未来需通过标准化方案、机制优化及技术创新,推动其从实验室走向临床应用。
【注】文章内容旨在科普特皮相关知识交流分享,了解行业前沿发展动态,不构成任何应用建议。
[3]Fayazi, N., Sheykhhasan, M., Soleimani Asl, S. et al. Stem Cell-Derived Exosomes: a New Strategy of Neurodegenerative Disease Treatment. Mol Neurobiol 58, 3494–3514 (2021).
[4]Enciso N, Amiel J, Pando J, Enciso J. Multidose intramuscular allogeneic adipose stem cells decrease
[5]Ryu B, Baek J, Kim H, et al. Anti-Inflammatory effects of M-MSCs in DNCB-induced atopic dermatitis mice. Biomedicines. 2020; 8(10): 439.
[6]Cho BS, Kim JO, Ha DH, Yi YW. Exosomes derived from human adipose tissue-derived mesenchymal stem cells alleviate atopic dermatitis. Stem Cell Res Ther. 2018; 9: 187.
[7]Villatoro AJ, Hermida-Prieto M, Fernández V, et al. Allogeneic adipose-derived mesenchymal stem cell therapy in dogs with refractory atopic dermatitis: clinical efficacy and safety. Vet Rec. 2018; 183(21): 654.
[8]Human umbilical cord mesenchymal stem cell therapy for atopic dermatitis through inhibition of neutrophil chemotaxis.
DOI: 10.1186/s13287-025-04349-8
由于微信最近的功能变动为了保证第一时间收到公众号消息,大家记得把公众号设置为星标。










Leave a Reply