日前,Incyte公司宣布FDA已批准其JAK抑制剂 Opzelura™ (ruxolitinib) 乳膏用于短期和非连续性长期治疗非免疫功能低下的12岁及以上轻中度特应性皮炎 (AD) 患者。这意味着Opzelura成为FDA批准的首个且唯一一个局部外用JAK抑制剂。
特应性皮炎(AD)是一种常见的慢性炎症性皮肤疾病,以反复发作的剧烈瘙痒和皮疹为主要临床表现,通常在婴儿期发病,部分患者病情迁延至成年。AD发病机制复杂,一般认为与遗传、环境、免疫等多种因素相关,据统计全球约2.6亿人受此疾病困扰。
传统AD治疗药物包括皮肤保湿润肤剂、外用类固醇或神经钙调蛋白抑制剂、环孢菌素为主的抗炎药物和减轻瘙痒的抗组胺药物。近年来,全球还批准了多款新兴AD治疗药物,如PDE4抑制剂Eucrisa(crisaborole,克立硼罗,2%软膏剂)、IL-4R靶向单抗Dupixent(dupilumab,度普利尤单抗)、JAK1/2抑制剂Olumiant(baricitinib)、IL-13靶向单抗Adtralza(tralokinumab)。其中Olumiant有效成分baricitinib是Incyte公司开发的一款口服JAK1/2抑制剂,后授权给礼来,2020年11月该药被EMA批准用于治疗适合系统疗法的中度至重度AD成人患者,然而该药治疗AD适应症的审查期被延迟,预计将在今年第三季度初就收到FDA回复的,但目前迟迟未见获批的消息公布。
Opzelura是JAK1/2抑制剂ruxolitinib的专利配方制剂,专为局部应用而设计,除用于治疗AD,还被开发用于治疗白癜风。
此次Opzelura获批是基于其治疗AD临床项目TRuE-AD的积极结果。该项目包括2项设计相同的随机、赋形剂对照、关键3期研究TRuE-AD2(NCT03745651)和TRuE-AD1研究(NCT03745638),共入组了1250例患者,评价Opzelura每日2次治疗青少年和成人(年龄≥12岁)轻中度AD的安全性和有效性。
这两项3期研究均达到主要终点——治疗第8周,与赋形剂组([非药物乳膏剂];TRuE AD1:15.1%;TRuE AD2:7.6%)相比,0.75%乳膏组(TRuE AD1:50.0%;TRuE AD2:39.0%)和1.5%乳膏组(TRuE AD1:53.8%;TRuE AD2:51.3%)有显著更高比例的患者实现IGA-TS治疗成功(p值均<0.0001)。
此外,这两项研究还达到两个关键次要终点——(1)治疗第8周,与赋形剂组(TRuE AD1:24.6%;TRuE AD2:14.4%)相比,0.75%乳膏组(TRuE AD1:56.0%;TRuE AD2:51.5%)和1.5%乳膏组(TRuE AD1:62.1%;TRuE AD2:61.8%)有更高比例的患者实现EASI75(湿疹面积和严重程度指数评分较基线水平改善≥75%;p值均<0.0001);(2)与赋形剂组(TRuE AD1:15.4%;TRuE AD2:16.3%)相比,0.75%乳膏组(TRuE AD1:40.4%;TRuE AD2:42.7%)和1.5%乳膏组(TRuE AD1:52.2%;TRuE AD2:50.7%)有更高比例的患者实现NRS4(瘙痒数值评定量表评分改善≥4分;分别为:p<0.001,p<0.0001,p<0.0001,p<0.0001)。
安全性方面,治疗8周期间2种剂量乳膏剂治疗组与赋形剂组治疗出现的不良事件(TEAE)总体发生率、严重不良事件发生率均具有可比性。没有观察到新的安全信号。
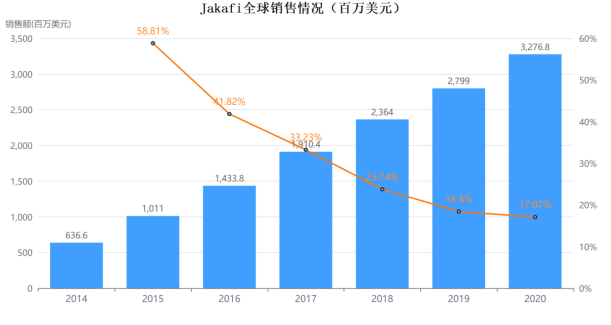
其实 Opzelura活性成分ruxolitinib的口服剂型Jakafi早已于2011年11月被FDA批准用于骨髓纤维化,随后又被批准用于治疗真性红细胞增多症(2014/12)和类固醇难治性急性移植物抗宿主病(2019/05)。诺华负责Jakafi在美国以外市场,Incyte负责该药在美国的市场,据药融云数据库,Jakafi目前已经入重磅行列,2020年全球销售额高达32.768亿美元。
此外,双喜临门的是,紧跟 Opzelura在美国获批,Jakafi在美国迎来第四个适应症——成人和12岁及以上的儿童一线或二线全身治疗失败后的慢性移植物抗宿主病 (GVHD)。
<END>
本文转自公众号药物简讯




Leave a Reply