“ 特应性皮炎(AD)是一种慢性、复发性炎症性皮肤病,伴有剧烈瘙痒,严重影响患者生活质量。目前,尚无治愈 AD 的方法,治疗目标是达到并维持长期缓解。近日,两项日本III期临床试验评估了 1% Tapinarof 乳膏治疗 AD 的疗效和安全性,为患者带来新希望。”
研究背景与目的
AD 发病机制复杂,涉及遗传、环境、皮肤屏障功能受损和免疫反应失调等因素。现有治疗以局部皮质类固醇为主,但长期使用可能导致皮肤萎缩等不良反应。Tapinarof 是一种非甾体、局部外用的芳烃受体(AhR)激动剂,可调节炎症反应、改善皮肤屏障功能,此前在II期试验中显示出有效性和安全性。本次III期试验旨在进一步评估其在日本 AD 患者中的疗效和安全性。
试验设计与方法
-
- 试验设计
- ZBB4 – 1 试验:在日本40个试验点进行,包括8周双盲治疗期(期 1)和16周扩展治疗期(期 2)。期1为随机、双盲、赋形剂对照试验,患者按 2:1 随机分配至 Tapinarof 组或赋形剂组;期 2 为开放标签、非对照试验,所有患者均接受 Tapinarof 治疗。
-
- ZBB4 – 2 试验:在日本 47 个试验点开展,是一项 52 周的开放标签、非对照试验,所有患者均接受 Tapinarof 治疗。
- 两项试验均遵循良好临床实践指南和赫尔辛基宣言,方案经各试验点机构审查委员会批准,患者或其法定监护人提供书面知情同意。
- 患者选择
- 两项试验均纳入年龄≥12岁、根据日本皮肤病学会标准临床诊断为 AD、体表面积受累≥5% 且≤30%(头皮除外)的日本患者。ZBB4-1 试验要求患者 IGA 评分 3(中度)或 4(重度)且 EASI 评分≥10;ZBB4-2 试验要求 IGA 评分 2(轻度)、3 或 4 且 EASI 评分≥5。排除有严重皮肤病或炎症性疾病、急性活动性皮肤感染或在基线前特定时期内使用过 AD 治疗的患者。
- 两项试验均纳入年龄≥12岁、根据日本皮肤病学会标准临床诊断为 AD、体表面积受累≥5% 且≤30%(头皮除外)的日本患者。ZBB4-1 试验要求患者 IGA 评分 3(中度)或 4(重度)且 EASI 评分≥10;ZBB4-2 试验要求 IGA 评分 2(轻度)、3 或 4 且 EASI 评分≥5。排除有严重皮肤病或炎症性疾病、急性活动性皮肤感染或在基线前特定时期内使用过 AD 治疗的患者。
- 试验设计
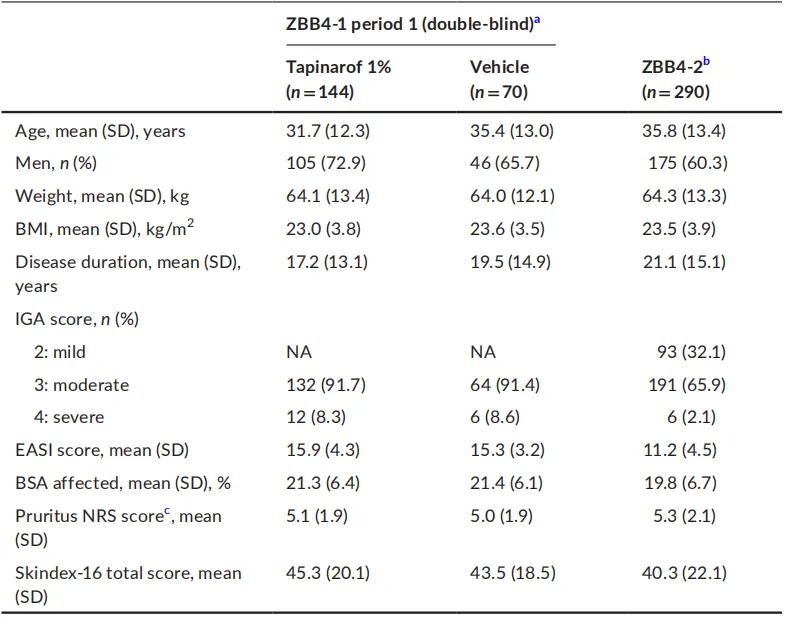
患者人口统计学和基线疾病特征
- 试验治疗
- 患者每日一次将试验药物薄涂于所有 AD 皮损(头皮除外),包括新出现的皮损。ZBB4-1 期 1 中皮损消退后继续用药,期 2 和 ZBB4-2 中可由研究者决定是否中断。试验期间禁止使用其他 AD 治疗药物,但在 ZBB4-1 期 2 和 ZBB4-2 中,若 AD 皮损未改善,可由研究者酌情使用救援治疗(多为局部皮质类固醇)。
- 评估指标
- 研究者在每次试验访视时评估 IGA、EASI 和体表面积(BSA)受累百分比。患者在 ZBB4 – 1 期 1 每日记录瘙痒数字评分量表(NRS),在期 2 和 ZBB4 – 2 每次访视时评估。患者在特定访视时完成 Skindex – 16 问卷以评估 AD 对生活质量的影响。
试验结果
-
- 患者情况
- 在 ZBB4 – 1 试验中,216 例随机患者,期 1 时 144 例接受 Tapinarof 治疗,72 例接受赋形剂治疗。191 例完成期 1 的患者中,135 例继续接受 Tapinarof 治疗,56 例从赋形剂转换为 Tapinarof 治疗。共有 176 例患者完成期 2。在 ZBB4 – 2 试验中,291 例接受 Tapinarof 治疗的患者中,237 例完成试验。试验中止的常见原因包括不良事件和患者退出。期 1 时两组患者人口统计学和基线疾病特征无明显差异,ZBB4 – 1 试验纳入的患者 AD 病情较 ZBB4 – 2 试验更严重。
- 疗效结果
- ZBB4 – 1 试验期 1:Tapinarof 组在主要终点(第 8 周 IGA 治疗成功率,20.24% vs 2.24%,p = 0.0007)和关键次要终点(第 8 周 EASI – 75 缓解率,40.3% vs 4.3%,p < 0.0001)均显著优于赋形剂组。Tapinarof 组在其他次要终点如 BSA 受累百分比、瘙痒 NRS 评分和 Skindex – 16 评分等方面也有更大改善,且瘙痒 NRS 评分快速降低。
- ZBB4 – 1 试验总体:Tapinarof 组 IGA 治疗成功率和 EASI – 75 缓解率在第 24 周前持续增加,分别达到 46.2% 和 69.7%。赋形剂转换为 Tapinarof 治疗的患者,转换后疗效指标快速上升。
- ZBB4 – 2 试验:IGA 评分和 EASI 评分相关的缓解率随时间增加并维持至 52 周,如 IGA 治疗成功率在第 52 周为 41.3%,EASI – 75 缓解率为 76.6%。其他疗效终点改善也持续至 52 周。
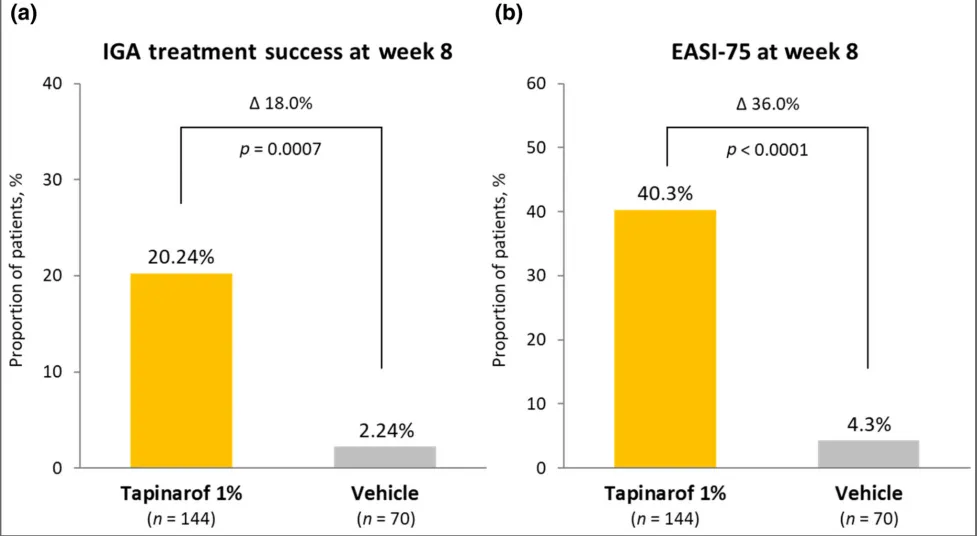
ZBB4-1试验阶段1主要和关键次要终点
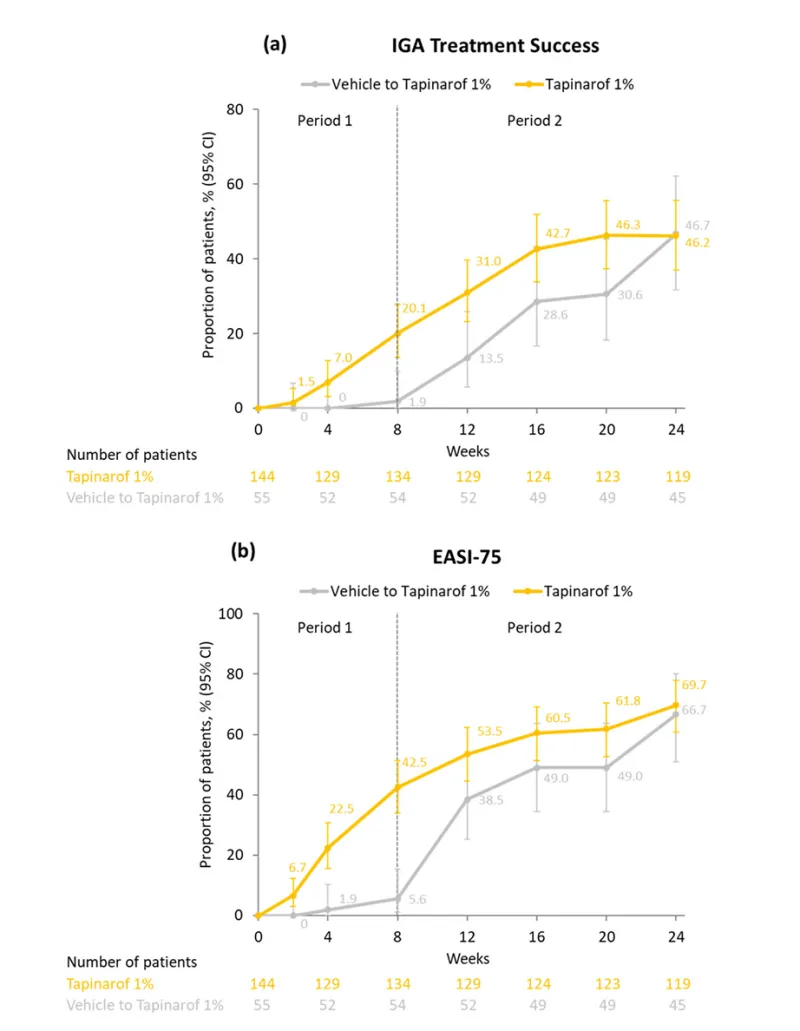
ZBB4-1整体试验期间(a)IGA应答率和(b)EASI-75应答率
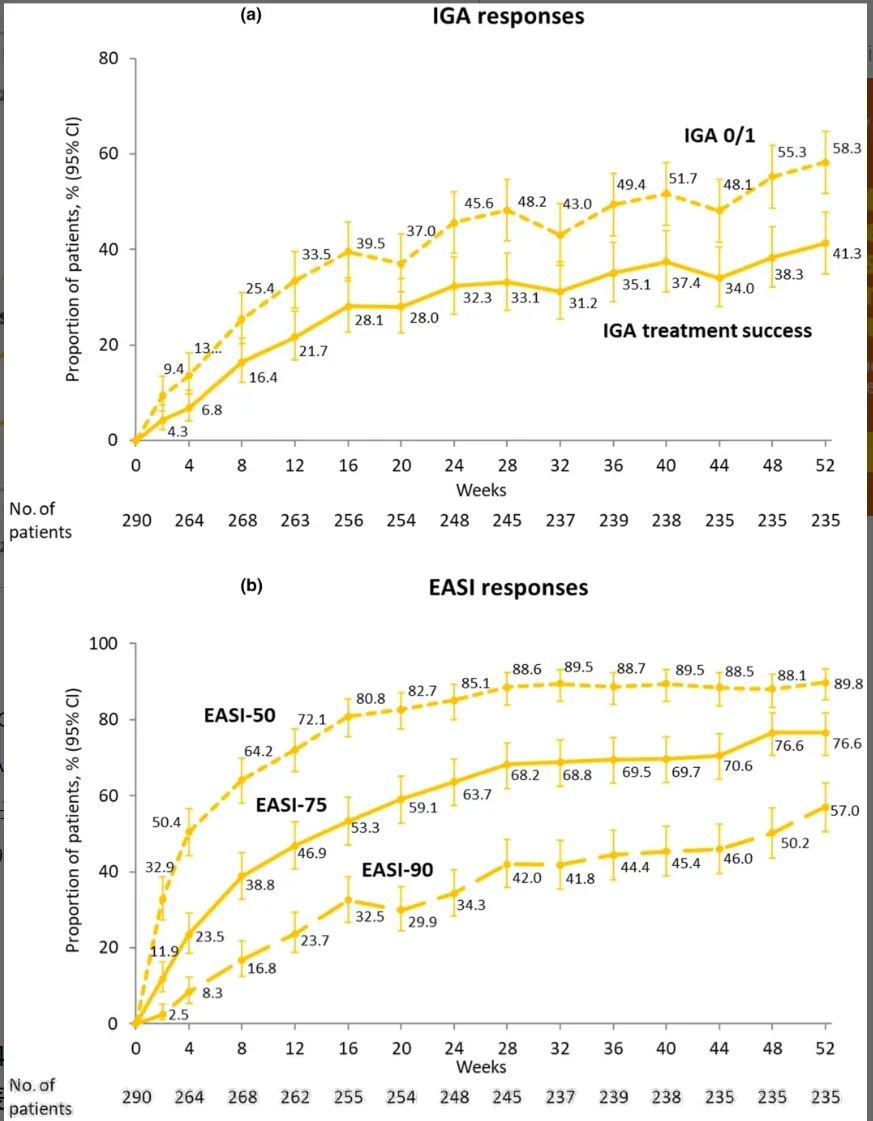
ZBB4-2试验的主要和关键次要终点
- 安全性结果
- 患者情况
Tapinarof 乳膏治疗特应性皮炎的不良反应主要包括皮肤相关反应和头痛等,多为轻中度,严重不良反应较少,具体情况如下:
-
-
- 皮肤相关不良反应
- 毛囊炎和痤疮:在 ZBB4 – 1 试验期 1,Tapinarof 组中应用部位毛囊炎发生率为 11.8%,应用部位痤疮发生率为 7.6%,痤疮发生率为 2.8%;在汇总安全人群中,应用部位毛囊炎发生率为 19.3%,应用部位痤疮发生率为 16.1%,痤疮发生率为 17.3%。这些皮肤不良反应可能与 Tapinarof 导致的角质层成分(如丝聚蛋白、兜甲蛋白和内披蛋白)上调,进而引起毛囊角化过度和堵塞有关。研究认为 Tapinarof 引发的毛囊炎事件无感染性,形态与毛周角化病相似。
- 其他皮肤反应:在汇总安全人群中,接触性皮炎发生率为 7.2%,皮肤乳头状瘤发生率为 6.4%,皮疹发生率为 8.0%。
- 头痛
- 在 ZBB4 – 1 试验期 1,Tapinarof 组头痛发生率为 16.0%;在汇总安全人群中,头痛发生率为 20.5%。Tapinarof 引发的头痛中位首次发作时间为 2.0 天,中位最大持续时间为 3.0 天,一般在治疗早期发生且持续时间短。目前未发现头痛与 Tapinarof 血浆浓度、应用面积或乳膏使用量有明显关系,其发生机制仍需进一步研究2。
- 其他不良反应
- 在汇总安全人群中,发热发生率为 12.5%,鼻咽炎发生率为 7.8%,COVID – 19 发生率为 12.7%。
- 皮肤相关不良反应
-
严重不良反应方面,在汇总安全人群中,4.0% 的患者发生严重不良事件,但均不被认为与治疗相关;2.4% 的患者发生重度不良事件,其中 1 例特应性皮炎和 1 例毒性皮疹被认为与治疗相关(毒性皮疹患者主要在应用部位出现特应性皮炎症状加重,研究者认为是 Tapinarof 吸收进入体内所致,但该患者未报告 Tapinarof 血浆浓度升高)。
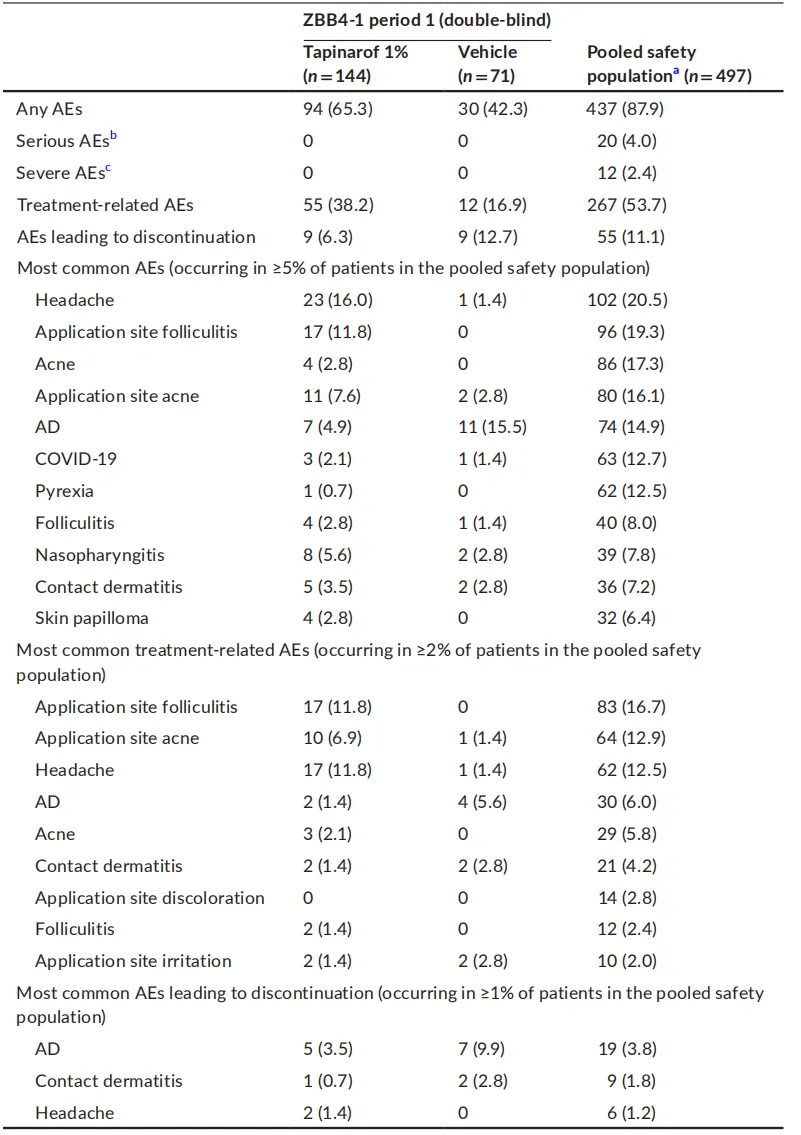
不良事件总结
- 药代动力学结果
- 在 ZBB4 – 1 和 ZBB4 – 2 试验中,约 70% – 90% 患者在各时间点血浆中 Tapinarof 浓度低于定量下限,平均血浆浓度随时间下降,最高血浆浓度范围为 474 – 20900 pg/mL,浓度最高患者(ZBB4 – 2 试验第 4 周,20900 pg/mL)无治疗相关不良事件。
研究结论
Tapinarof 乳膏 1% 在治疗日本 AD 患者中显示出良好疗效,在 8 周治疗时优于赋形剂,且疗效随治疗持续增加并维持 52 周。多数不良事件为轻中度,常见不良事件包括毛囊炎、痤疮和头痛,Tapinarof 乳膏治疗总体安全,有望为 AD 治疗提供新选择。不过,研究存在局限性,如 ZBB4 – 1 期 1 仅设赋形剂对照,未纳入年龄小于 12 岁患者,且 Tapinarof 治疗超过 52 周的疗效和安全性有待评估。未来还需进一步研究其与现有疗法联合使用的效果,以明确其在 AD 治疗中的定位。
参考文献:Igarashi A, Tsuji G, Fukasawa S, Murata R, Yamane S. Tapinarof cream for the treatment of atopic dermatitis: Efficacy and safety results from two Japanese phase 3 trials. J Dermatol. 2024 Sep 13. doi: 10.1111/1346-8138.17451. Epub ahead of print. PMID: 39269202.
由于微信最近的功能变动为了保证第一时间收到公众号消息,大家记得点击公众号的设置-设置为星标。




AD家园病友-微信群






Leave a Reply