


-
任中华医学会皮肤性病学分会第十三届主任委员,中国康复医学会常务理事,中国康复医学会皮肤性病学分会名誉主委,世界华人医师协会皮肤科医师协会副会长,中华医学会皮肤性病学分会特应性皮炎(湿疹)研究中心首席专家, 中国毛发研究会会长。《中华皮肤科杂志》、《临床皮肤科杂志》等杂志副主编,JAAD,CMJ等杂志编委。 -
在国际上首次报告“特应性皮炎样移植物抗宿主病”,首次报告RPL21基因是先天性少发症的致病基因,提出了特应性皮炎诊断的“中国标准”。在国内首先发现游泳池肉芽肿病,组织了我国多种皮肤病诊疗指南的制定,主编我国首部国家卫健委统编长学制教材《皮肤性病学》,牵头研发的皮肤病新药本维莫德获2019年国家重大医学成果,牵头几十项国际多中心/国内多中心药物临床试验,发表论文500余篇,主编和参编50多部著作,获国家科技进步奖、中华医学奖、国际皮肤科联盟杰出贡献奖等国内外奖多项,2018年获“国家名医”称号。
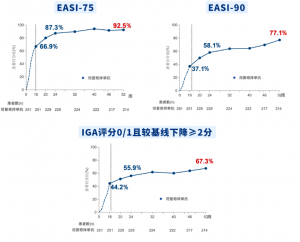
EASI-90:湿疹面积和严重程度指数较基线改善至少90%
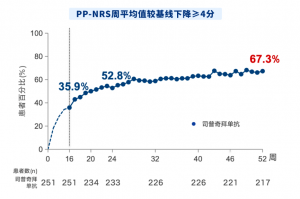
PP-NRS:峰值瘙痒数字评估量表
DLQI:皮肤病生活质量指数
POEM:湿疹自我检查评分量表
参考出处:
1. Zhao Y, Zhang L, Zhang J, et al. J Am Acad Dermatol. 2024 Nov;91(5):984-986. doi: 10.1016/j.jaad.2024.07.1447.
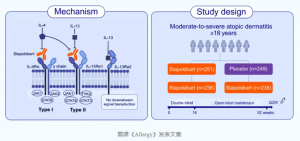
2. Zhao Y, Zhang L, Wu L, et al. Allergy. 2024;00:1-10. doi:10.1111/all.16368.





Leave a Reply