
这是一项 III 期、随机、双盲、安慰剂对照、平行组、3 组、多国家、多中心研究,旨在评价 12 岁及以上中重度特应性皮炎受试者皮下接受Amlitelimab 单药治疗的疗效和安全性。该研究在北美、拉丁美洲、欧洲、亚太和中东的 15 个国家/地区开展。
研究的主要终点为接受 Amlitelimab(Q4W 或 Q12W)治疗的患者在第 24 周时进行测量:
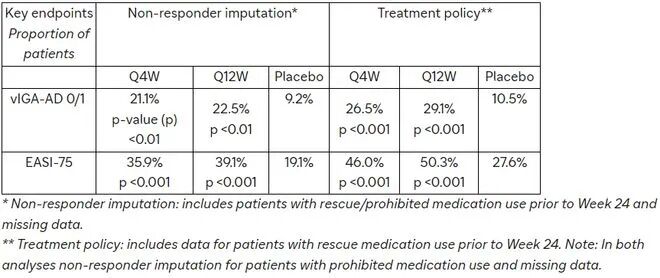
- 对于美国和以美国为参考的国家的主要终点第 24 周特应性皮炎研究者总体评估量表(vIGA-AD)为 0(清除)或 1(几乎清除)且较基线降低≥2 分的受试者比例;
- 对于欧盟、以欧盟为参考的国家和日本的并列主要终点第 24 周经验证的 vIGA-AD 为 0 或 1 且较基线降低≥2 分的受试者比例,以及湿疹面积和严重程度指数评分较基线降低 75%(EASI-75)的受试者比例。
结果显示,Amlitelimab 每四周(Q4W)或每十二周(Q12W)给药一次,均达到了所有主要终点和关键次要终点。在 12 岁及以上中重度特应性皮炎患者中,与安慰剂相比,在第 24 周时,其皮损清除率和病情严重程度均达到统计学上显著且具有临床意义的水平。
在第 24 周,两个给药组也实现了研究的关键次要终点,包括达到 vIGA-AD 0/1的患者比例,以及在基线 PP-NRS ≥4 的患者中,峰值瘙痒数值评定量表 (PP-NRS) 与基线相比减少≥4 分的患者比例。
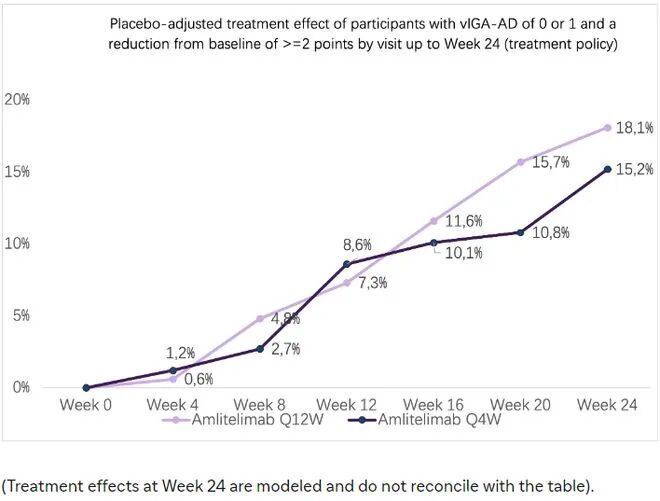
此外,在两个给药组中,疗效在整个治疗期间持续增加,未出现平台期。
安全性方面,Amlitelimab 耐受性良好,本研究中未发现新的安全性问题。完整的结果将在即将召开的医学会议进行展示。
Amlitelimab 是一种具有全新作用机制的全人源单克隆抗体,可与关键的免疫调节剂 OX40 配体结合,有望成为治疗一系列免疫介导疾病和炎症性疾病(包括中度至重度特应性皮炎和哮喘)的首创药物,且疗效持久,给药频率低。每年仅需给药四次。









Leave a Reply